濟南尚博醫藥股份有限公司連續通過兩項原料藥生產質量檢查
近日,濟南尚博醫藥股份有限公司(以下簡稱尚博醫藥)以零缺陷(“0-483”)正式通過美國FDA的cGMP(現行藥品生產質量管理規范)檢查。此次是尚博醫藥首次接受美國FDA現場檢查,“零缺陷通過”標志著公司質量管理體系和質量管理能力獲得國際權威藥監機構認可,為產品進軍歐美高端市場、提升競爭力奠定基礎。
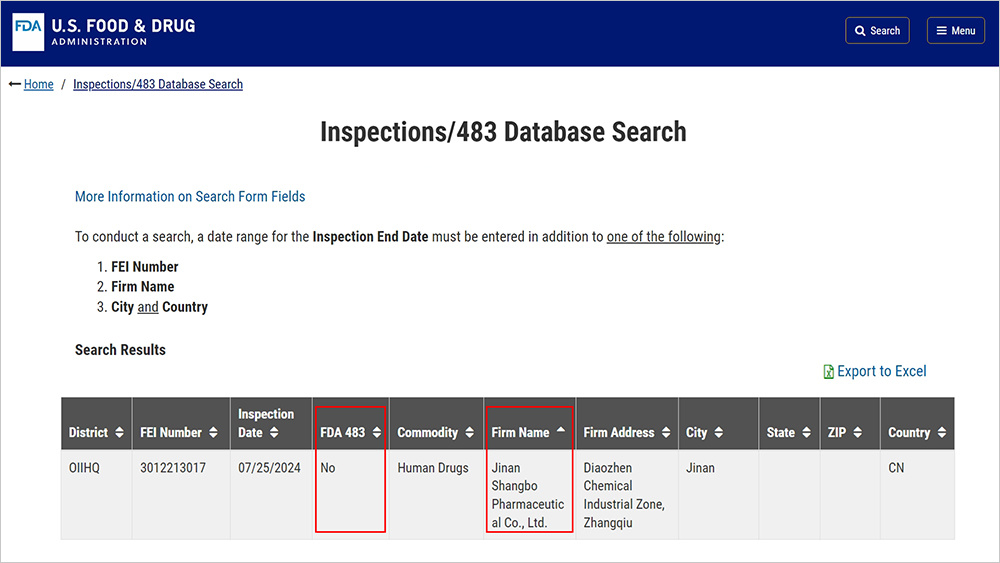
2024年7月,美國FDA對尚博醫藥進行了為期4天的cGMP現場檢查,此次檢查涉及非無菌原料藥瑞美吉泮中間體的生產制造,檢查范圍涵蓋質量、實驗室、生產、設施與設備、物料、包裝和標簽等系統。公司先進的生產設施、質量管控及專業素養極高的團隊,給審查人員留下深刻印象。
2024年10月26日,尚博醫藥正式收到山東省藥品監督管理局簽發的《藥品生產許可證》(D證)。此次為尚博首次申請藥品生產許可證核發,申請核發品種為原料藥(阿昔莫司)。

檢查組主要從機構與人員、生產管理、廠房與設施、設備、質量保證與質量控制、物料與產品、文件管理、確認與驗證、產品發運與召回、委托生產與委托檢驗、自檢等方面對尚博醫藥進行為期兩天的原料藥許可檢查,一致認為該企業質量管理體系基本健全,本次關于原料藥(阿昔莫司)(K 車間四號生產線)的“藥品生產許可核發”現場檢查初步結論為:符合要求。這標志著我公司原料藥的機構與人員、廠房設施、物料管理等符合《藥品生產質量管理規范》的標準,具備合法生產原料藥(阿昔莫司)的資質。

多年來,尚博醫藥秉承著“以人為本,客戶至上”的經營理念,始終將產品質量放在首位,建立健全了穩定的質量運行機制和質量保證體系,培養出一支高素質、專業化的生產和管理團隊,不斷提升生產效率和產品質量,以專業技能與優質服務贏得客戶信賴。未來,尚博醫藥將繼續堅守高標準的生產質量管理,不斷創新研發,為推動全球醫藥行業高質量發展貢獻智慧和力量。
上一篇: 泉城海關關長王波一行到圣泉集團調研




















